汉氏联合新药专辑①:六个干细胞新药IND获批
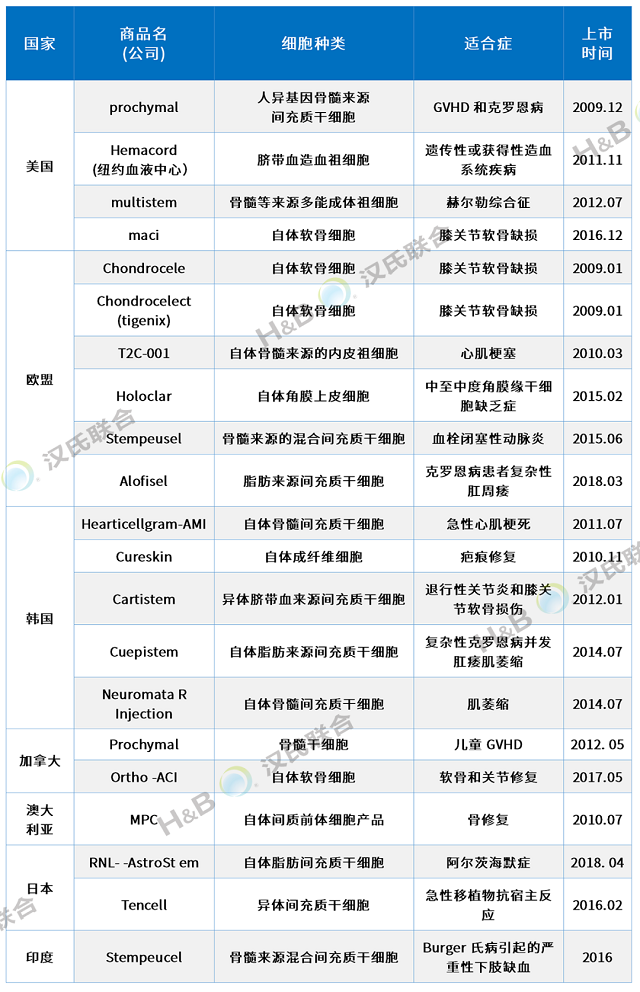
全球21个干细胞药物上市,适应症广泛
截止到2021年6月1日,用“stem cell”作为关键词,在ClinicalTrials.gov网站检索到8565项登记注册的干细胞临床试验方案。按国家和地区统计,全球干细胞临床研究排名前三的国家或地区分别是美国(4369项)、欧洲(2036项)和中国(709项)。新的研究领域和新方法的推动,以及各国政府政策的支持,促进了干细胞治疗的快速发展。

目前,全球已有21款药物上市,适应症包括膝关节软骨缺损、移植物抗宿主病、克罗恩病、骨修复、急性心肌梗死、遗传性或获得性造血系统疾病、退行性关节炎和膝关节软骨损伤、克罗恩病并发肛瘘、赫尔勒综合征、肌萎缩性侧索硬化症、中度至重度角膜缘干细胞缺乏症、血栓闭塞性动脉炎等疾病。
根据Polaris Market Research发布的最新研究报告,2018—2026年全球间充质干细胞市场预计以7.3%的复合年增长率增长。同样,全球市场调研机构ARC(AnalyticalResearch Cognizance)发布的报告也显示,全球间充质干细胞市场发展迅速,预计至2024年底其市场值将达到2.2亿美元。
国内政策明朗,国产干细胞药物崛起
医疗机构开展的干细胞临床研究是由中华人民共和国卫生健康委员会和国家药品监督管理局协同共管,以《中华人民共和国药品管理法》为法律依据,遵行《干细胞临床研究管理办法(试行)》和《干细胞制剂质量控制及临床前研究指导原则(试行)》,以医疗机构为主体,实行干细胞临床研究机构和项目的双备案。如后续申请药品注册临床试验,可将已获得的临床研究结果作为技术性申报资料提交并用于药品评价,按照药品审批程序进行。
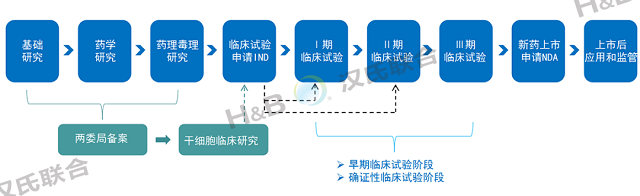
间充质干细胞药物申报路径
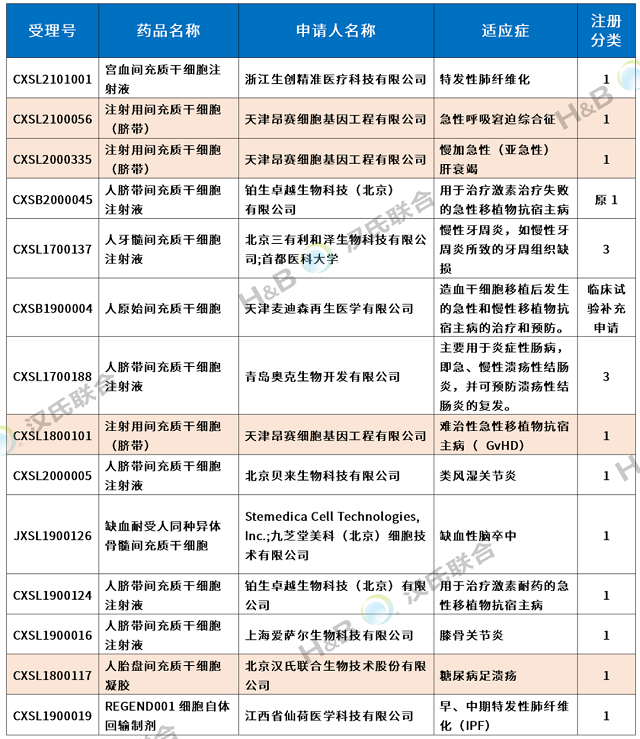
2018年6月至今,国内相继有14款干细胞新药的IND申请获国家药品审评中心(CDE)正式受理,除了REGEND001细胞自体回输制剂为自体肺基底层上皮细胞外,其它13款均为间充质干细胞。
汉氏联合6个新药IND获批,国内一路领先
2021年4月21日,汉氏联合集团旗下子公司天津昂赛细胞基因工程有限公司提报的干细胞1类新药:注射用间充质干细胞(脐带)的新药临床试验申请获得国家药监局药品审评中心(CDE)默示许可(CXSL2100056)。自此,汉氏联合集团共有6个干细胞新药临床试验获批,其中一个新药“高活性人脐带间充质干细胞注射液”I/IIa期临床试验获得法国药监局(ANSM)签发许可,用于治疗“重度下肢缺血”。
间充质干细胞是细胞治疗的明星细胞
根据《中华人民共和国药品管理法》第二条关于药品的定义:本法所称药品,是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药、化学药和生物制品等。药品直接关系到人们的身体健康甚至生命存亡。因此,其质量不得有半点马虎,必须确保药品的安全、有效、均一、稳定。
鉴于特殊干细胞及其衍生物是一种全新的生物制品,其生产过程的质量把控,包括纯度、稳定性和效能的检测、研究人员的技术操作等,直接关系到试验的风险和受试者的安全;与化药相比,具有活性的细胞制品要保证其均一稳定性,则需要更全面监测手段,更严谨的工作流程,以及更稳妥的物流运输做保障。
1. 间充质干细胞的安全性
2012年韩忠朝院士团队在《Stem Cells International》杂志上发表综述“Safety of Mesenchymal Stem Cells for Clinical Application”,表明脐带间充质干细胞没有成瘤的风险,并且间充质干细胞在裸鼠等动物上应用无致敏性和没有明显毒性。

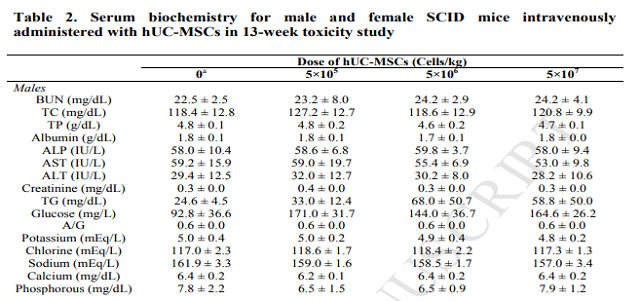
韩国学者用人脐带来源的间充质干细胞在急性肝损伤中的作用。分别设定高剂量组(5×10^7个/kg ),中剂量组(5×10^6个/kg),低剂量组(5X10^5个/kg)和空白对照组,历经13周后,在体重,血清生化、尿检、血液学检测、器官重量上没有显著的变化;
将脐带间充质干细胞静脉注射入C57BL/6鼠体内,其致瘤性实验结果显示:历经26周后,阳性对照组100%长瘤,阴性对照组和实验组均无长瘤,说明脐带间充质干细胞无致瘤性。

特别是移植13周后,小鼠主要器官中hUC-MSCs未被检测到,也没有发现全身性毒性或肿瘤。综上所述,这些结果表明hUC-MSCs在未来的临床治疗疾病具有很大的潜力。
2. 均一性、稳定性的间充质干细胞
间充质干细胞的质控体系,贯穿于细胞生产工艺的每个环节,包括组织采集,细胞分离、扩增、收获,以及产品放行。每个生产环节,都需要相应的质量控制方法和标准。国家卫健委明确规定: 通过中国食品药品检定研究院检定的干细胞产品才能用于临床疾病治疗研究。
汉氏联合自主研发的胎盘和脐带间充质干细胞产品,均已通过了中国食品药品检定研究院检定。汉氏联合集团旗下子公司天津昂赛细胞基因工程有限公司细胞检测实验室获得中国合格评定国家认可委员会(CNAS)颁发的细胞检测国家实验室认可证书,证书号:CNASL11892,标志着公司细胞检测实验室具备国家及国际认可的管理水平和检测能力。CNAS细胞检测实验室所提供的检验报告国际同行认可,出具的检验报告可得到全球100多个国家和地区的检测结果互认。

在国家利好政策前提下,我国科学研究者积极研发与探索,相信不久将来我国将迎来首个本土干细胞药物。


